Substitutionsreaktioner
Substitution betyder att byta ut något. I substitutionsreaktioner bytts en atom eller en atomgrupp mot en annan atom eller atomgrupp.
Additionsreaktioner
I additionsreaktioner adderar/lägger vi till en ny grupp till en molekyl.
Elimineringsreaktion
I elimineringsreaktioner eliminerar det vill säga "tas bort" en grupp i en molekyl.
Kondensationsreaktioner/Hydrolysreaktioner
I kondensationsreaktioner förenar vi två molekyler och det avges vatten i processen. I hydrolys klyvs en molekyl genom att addera vatten. Denna reaktion är motsatsen till kondensationsreaktioner.
Redoxreaktioner
När ett grundämne oxideras och ett annat reduceras. Oxidation sker ofta genom att syre adderas till en molekyl.
Syra-bas-reaktioner
Vissa organiska molekyler genomgår protolysreaktioner
Reaktioner av alkaner
Alkaner: Är mättade kolväten. Eftersom bindningarna i alkaner är stabila är de reaktionströga.Alkaner reagerar sakta med halogenerna klor (Cl2) och fluor (F2) i en substitutionsreaktion:
CH4 + Cl2 + energi → CH3-Cl + HCl
Vid överskott av klor bildas förutom metylenklorid (CH3Cl), också diklormetan (CH2Cl2 ), kloroform (CH-Cl3) och koltetraklorid (CCl4).
Om halogenen spjälkas till en radikal genom strålning (UV-ljus = hv) går substitutionen fortare i en radikalreaktion.
CH4 + Cl2 + hv→ CH3-Cl + HCl
Mekanismen i radikalreaktionen:
Initiering: Cl2 molekylen klyvs genom inverkan av ljus till två klor radikaler*.
Cl2 → Cl• + Cl•
*Radikal, är en atom eller molekyl som har oparade elektroner i den yttersta/högsta energinivån (orbitalen). Detta gör ofta radikaler mycket reaktiva.
Propagering: När reaktionen har startat genom bildandet av klor radikaler så går den av sig själv.
CH4 + Cl• → CH3• + HCl
CH3• + Cl2 → CH3Cl + Cl•
Terminering: Detta är reaktioner som inte leder till produktion av en radikal. Antal radikalerna minskar in koncentration och reaktionen avstannar.
CH3• + CH3• → CH3 − CH3
CH3• + Cl• → CH3Cl
Cl• + Cl• → Cl2
Alkaner kan genomgå elimineringsreaktion och bildar alken processen kallas cracking.
Reaktionen sker vid hög temperatur (ca. 800 Co).
CH3− CH3 → CH2 = CH2 + H2
Reaktion av alkener
Alkener är framförallt involverade i additionsreaktioner.
Anledningen till detta är att alkener har en funktionell grupp, dubbelbindningen.
Hydrogenering av alken är addition av väte involverande nickel (Ni) eller platina (Pt) katalys.
Hydrogenering av alken är addition av väte involverande nickel (Ni) eller platina (Pt) katalys.
CH2 = CH2 + H2 —[katalys: Pt]→ CH3− CH3
Halogenering av alkener är addition av halogener.
CH2 = CH2 + Br2 → CH2Br −
Hydrering: Reaktion mellan vatten och eten med syrakatalys (svavelsyra) är addition av vatten.
CH2 = CH2 + H2O —[katalys: H2SO4]→ CH2OH − CH3
Addition av HCl (väteklorid) till eten. Alkener reagerar också med andra vätehalider. Reaktionshastigheten följer ordningen HI>>HBr>HCl.
CH2 = CH2 + HCl → CH3 − CH2Cl
Alkener kan oxidera i närvaro av KMnO4 till alkohol under basiska förhållanden och till keton och karboxylsyra under sura förhållanden.
CR2 = CR2 + H2O —[katalys: OH- och KMnO4]→ CR2OH − CR2OH (diol)
CR2 = CHR + H2O —[katalys: H+ och KMnO4]→ COR2 + RCOOH (ketoner/karboxylsyra)
Oxidationstal för kol
I bindningen C-H är oxidationstalet för väte +1 vilket innebär att oxidationstalet för kol minskar med 1 för varje väte som läggs till.
Bindningar till atomer av samma slag förändrar inte oxidationstalet. Exempelvis har kolatom som binder till fyra andra kolatomer har oxidationstalet 0.
Varje bindning av kol till ett elektronegativ atom som O, N, Cl ökar oxidationstalet på kol med 1.
Exempel:
Kolet i metan CH4 har oxidationstalet - 4.
Kolet i propan CH3 CH3 har oxidationstalet -3.
Kol 1 i 1-buten har oxidationstalet -2.
Kol 1 i 1-butanol har oxidationstalet -1.
Kolet i koltetraklorid har oxidationstalet +4.
Karboxylsyrakolet i en karboxylsyra har oxidationstalet +3.
Reaktion av alkoholer
Primära alkoholer (R-OH) oxideras [o] till aldehyder (R-COH) och sedan vidare till karboxylsyra.
 |
| Exempel: etanol oxideras till ättiksyra CH3CH2OH —[o]→ CH3CHO —[o]→ CH3COOH |
Sekundära alkoholer R-CHOH-R oxideras till ketoner R-CO-R.
 |
| Exempel: 2-propanol oxideras till propanon CH3CHOHCH3 —[o]→ CH3COCH3 |
Tertiära alkoholer R3COH oxideras inte.
 | |
|
Grupperna -H och -OH elimineras.
 |
Exempel: etanol eliminerar vatten och bildar eten
CH3CH2OH → CH2CH2 + H20
|
Alkoholer kan (vid vissa omständigheter) avlägsna vatten genom kondensationsreaktion där ) varvid det bildas vatten.
 |
| Exempel: etanol eliminerar vatten och bildar dietyleter 2CH3CH2OH → CH3CH2-O-CH2CH3 + H2O |
Reaktion av aldehyder och ketoner
Aldehyer oxideras till karboxylsyror men ketoner oxideras inte. |
Exempel: etanal oxideras till eatansyra
CH3CHO → CH3COOH
|
Aldehyder kan också reduceras till alkohol.
Reaktion av karboxylsyror
Reagerar med alkoholer i en syrakatalyserad reaktion och bildar ester i en kondensationsreaktion. Reaktionen är en jämviktsreaktion och estern han hydrolyseras till alkohol och karboxylsyra igen. Hydrolys är en kemisk process där en molekyl klyvs i två delar efter att en vattenmolekyl har adderats.
 |
Exempel: etanol och etansyra (ättiksyra) bilda estern etyletanoat
reaktionen är reversibel
CH3COOH + CH3CH2OH → CH3COOCH2CH3+ H2O
|
Karboxylsyra reagerar med aminer i syra-basreaktion. Värmer man på blandningen omvandlas saltet till amid i en kondensationsreaktin.
 |
Exempel: dimetylamin (bas) och etansyra genomgår protolysreaktion kvävet på aminen attakterar karbonylkolet varvid det bildas amid CH3COOH + CH3NHCH3 → (CH3)2-NCO-CH3+ H2O |
Reaktion av estrar
Estrar hydrolyseras i en basisk esterhydrolys eller ”förtvålningsreaktion”. |
Exempel: etyletanoat (etylacetat) hyrolyseras av vatten och bildar etansyra och etanol
CH3COOCH2CH3 + H2O → CH3COOH + CH3CH2OH |
Estrar kan genomgå transesterifiering. I detta fall bytts ut en alkylgrupp (R´´) mot en annan (R´) genom inverkan av en basisk katalys.
 |
| Alkoholen R1OH och estern R2OOCR genomgår transeserifiering då alkylgruppen R1 på alkoholen ersätter R2 gruppen på estern |
 |
Mekanismen för transesterifiering
|
Substitutionsreaktioner:
Elektrofil = underskott av elektroner.
Nukleofil = överskott av elektroner.
SN2 substitutionsreaktioner sker i ett steg mellan en nukleofil (Nuk:) och en molekyl med en bra lämnande grupp (LG).
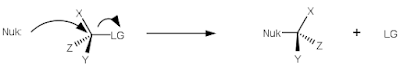 |
| Generellt: Nukleofil Nuk: attackerar molekyl med bra lämnande grupp LG |
Substitution av klor mot hydroxylgrupp (OH-)
 |
| kloridjon byts ut mot en hydroxylgrupp i en substitutionsreaktion SN2 |
Substitution av brom för en amin
 |
| brom byts ut mot aminogrupp i en substitutionsreaktion SN2 |


Inga kommentarer:
Skicka en kommentar