Kollisionsteorin
Det krävs kollision mellan de reagerande ämnena för att de ska kunna reagera!För att två ämnen ska kunna reagera (reaktanter) måste de komma i kontakt med varandra. Men detta räcker inte för att ämnena ska reagera. Förutom kollision mellan dem måste de kollidera med tillräcklig hastighet för att bryta bindningarna i de reagerande ämnena. Ämnena måste dessutom kollidera på ett speciellt sätt för att reaktion ska kunna äga rum. Alla kollisioner med tillräcklig hastighet leder således inte till en reaktion.
För att en reaktion ska kunna äga rum måste det bildas ett aktiverat komplex för detta det krävs energi
Reaktioner mellan två ämnen som kolliderar med varandra med tillräcklig hastighet, som motsvarar aktiveringsenergin, och på rätt sätt leder till ett aktiverat komplex. Det aktiverade komplexet faller sedan sönder och nya ämnen bildas som kallas produkter.
Reaktanter →Produkter
Reaktioner sker således i två steg. Först måste bindningar i reaktanter brytas vilket kräver energi (aktiveringsenergi) och sedan måste nya bindningar bildas vilket frigör energi.
Exempel: Reaktionen mellan eten och väteklorid molekyler.
 | |
|
- De reagerande ämnenas inneboende egenskaper.
- Koncentrationen hos reaktanter.
- Hur finfördelade reaktanterna är.
- Temperaturen på reaktionsblandningen.
- Närvaro av en katalysator.
De reagerande ämnenas inneboende egenskaper.
Vissa ämnen är mer reaktiva än andra, detta är ämnenas inneboende egenskap. Som exempel reagerar natrium (Na) snabbare med vatten än litium (Li). Orsaken till detta är att natrium lättare avger sin valenselektron än litium. Detta eftersom valenselektronen i natrium ligger längre från den positivt laddade kärnan och binds därför till atomen med en svagare kraft.Energi hos molekyler lagras i bindningar mellan atomer i molekylen. Energirika ämnen har därför bindningar mellan atomer som innehåller mycket energi. Det krävs därför endast liten energi för att bryta bindningen. Energirika molekyler reagerar därför fortare än energifattiga ämnen.
Koncentrationen hos reaktanter.
Reaktionshastigheten hos blandningar med hög koncentartion är högre är i blandningar med låg koncentration. Orsaken till detta är att hög koncentrtion leder till fler kollisioner per tidsenhet än om koncentrationen skulle vara låg. Fler kollisioner leder också till att kollisioner på "rätt sätt" (kollisioner som leder till reaktion) förekommer oftare.Efterhand som reaktanterna förbrukas sjunker koncentrationen och reaktionshastigheten minskar. Orsaken är att antal kollisioner minskar.
Hur finfördelade reaktanterna är.
Ämnen som är finkorniga reagerar snabbare än de som är grovkorniga. Finkorniga ämnen har en större ytarea än ämnen som är storkorniga. Finkorniga ämnen upplever därför fler kollisioner med varandra vilket leder till ökad reaktionshastighet.Temperaturen på reaktionsblandningen.
Temperatur påverkar molekylers kinetiska energi (rörelseenergi). Hög temperatur ger således molekyler en hög hastighet. En högre hastighet på molekyler i reaktionsblandningar ökar antal kollisioner mellan molekyler vilket ger fler kollisioner som leder till reaktion. Högre hastighet ökar också antal kollisioner som har tillräckligt hög energi för att bilda aktiverat komplex. Detta ger ytterligare ökad reaktionshastighet.Närvaro av en katalysator.
Katalysator är ett ämne som påskyndar en reaktion utan att själv förbrukas. Närvaro av en katalysator ger en reaktionsmekanism med lägre aktiveringsenergi. Lägre aktiveringsenergi ger fler kollisioner med tillräckligt hög energi (aktiveringsenergi) för att skapa aktiverat komplex. Fler aktiverade komplex leder i sin tur till förhöjd reaktionshastighet.Mer om energidiagram.
Energiförändringar i reaktioner illustereras ofta med såkallade energidiagram. För energi används begreppet entalpi (H) som är systemets inre energi (summan av atomernas kinetiska och potentiella energi).I följande energidiagram visas reaktionen där jod (I2) och vätgas (H2) bildas ur vätejodid (HI) vilket kräver kollision mellan två vätejodid molekyler.
2HI (g) → H2 (g) + I2 (g)
Om energin i kollisionen når upp till aktiveringsenergin bildas det aktiverat komplex och bindningar bryts vilket kräver energi. När nya bindningar åter bildast, frigörs det energi. Eftersom den frigjorda energin är lägre än den energi som krävdes (aktiveringsenergin) är processen endoterm och ΔH<0.
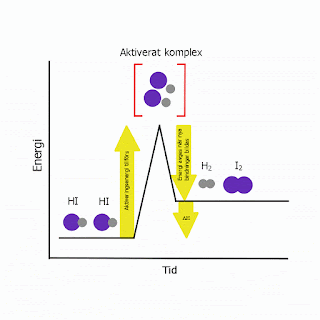 |
| Figuren visar en endoterm process då aktiveringsenergin är högre än den energi som bildas i reaktionen. |
Den omvända processen då vätejodid bildas ur vätgas och jod är exoterm och ΔH>0.
H2 (g) + I2 (g) → 2HI (g)
 |
| Figuren visar en exoterm process då aktiveringsenergin är lägre än den energi som bildas i reaktionen. |
1.1 Vad är aktiverat komplex?


Inga kommentarer:
Skicka en kommentar